Szén-monoxid
A szén-monoxid egy gáz halmazállapotú anyag. Valamennyi méreg közül a legtöbb ember haláláért felelős, de rendszerint véletlen mérgezés folytán.
Tulajdonságai
A szén a periódusos rendszer negyedik, az oxigén a hatodik főcsoportjában helyezkedik el, ennek megfelelően előbbinek négy, utóbbinak hat legkülső elektronja van. A szén és oxigénatom között háromszoros kovalens kötés alakul ki, ezek közül az egyik szigma, a másik pi, míg a harmadik az előzőektől kissé eltérő un. datív kötés. Ez azt jelenti, hogy a kötés kialakításában résztvevő mindkét elektronpárt az egyik, adott esetben az oxigén biztosítja. Így mindkét atomnak két-két nemkötő elektronpárja marad.
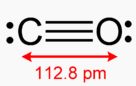
Színtelen, szagtalan gáz, mérgező gáz. Moláris tömege 28 g/mol, forráspontja -192 Celsius-fok, olvadáspontja: -205 Celsius-fok.
Előfordulása
A légkör természetes alkotója 0,05-0,2 ppm közötti értében. Ppm = parts per million, kis koncentrációk jellemzésére használt mérőszám, milliomod részt jelent. 0,05 ppm = 0,000005 %. Jelentős mennyiségben keletkezik tökéletlen égéskor: vulkáni tevékenység, erdőtűz, avarégetés, gépjárművek kipufogó gáza, dohányfüst, ipari tevékenység. A légkörben relatíve gyorsan szén-dioxiddá alakul.
Felhasználása
Fontos vegyipari alapanyag, többek közt metanol és ecetsav, továbbá festékek és műanyagok előállításához használják. Élelmiszeriparban becsomagolt húsáruk színének megőrzésére használják.
Élettani hatása
A vörösvértestben található hemoglobinhoz kapcsolódik, onnan leszorítja az oxigénmolekulát, annál mintegy 250-szer jobban kötődik a vörösvértesthez. 0,1%-nyi szén-monoxidot tartalmazó levegő fél órás belégzést követően a vérben lévő hemoglobin 50%-a karboxihemoglobiná alakul, amely a szervezet számára hasznosíthatatlan. További fél órányi belégzése biztos halálhoz vezet. Azért nevezik csendes gyilkosnak, mert gyakorlatilag semmilyen tünetet nem okoz, az enyhe émelygésből és fejfájásból percek alatt eszméletvesztés alakul ki.